靶向代谢抗衰老:谷氨酰胺与衰老细胞清除
代谢影响衰老的理念由来已久,但是对其深层次的了解仍然缺乏。2021年1月15日,东京大学医学科学研究所的Nakanishi Makoto教授和Johmura Yoshikazu助理教授及其合作者们在Science上发表题为《Senolysis by glutaminolysis inhibition ameliorates various age-associated disorders》的文章(原文链接见文末),阐述氨基酸代谢与衰老的关系,发现谷氨酰胺分解代谢在维持衰老细胞生存中的重要功能,抑制该代谢过程可以促进衰老细胞死亡、改善小鼠的健康寿命。
衰老在癌症等多种疾病的病理过程中发挥了重要作用。DNA损伤等压力应激会诱导细胞衰老,衰老细胞具有生长停滞、抵抗凋亡、核膜完整性破损、溶酶体功能异常、ROS水平上升等一系列特征。衰老细胞又被称为“僵尸细胞”,能分泌大量的促炎趋化因子和细胞因子(称为衰老相关分泌表型,SASP),通过旁分泌信号改变微环境,通过招募炎性免疫细胞、诱导纤维化和抑制干细胞等方式破坏组织的正常结构和功能,促进组织衰老,最终导致组织功能异常以及一系列衰老相关的病理变化。SASP还能能刺激肿瘤细胞增殖、肿瘤的血管生成以及转移。因此,利用药物特异性诱导衰老细胞死亡从而达到清除衰老细胞的方法被视为治疗衰老相关疾病的重要策略。
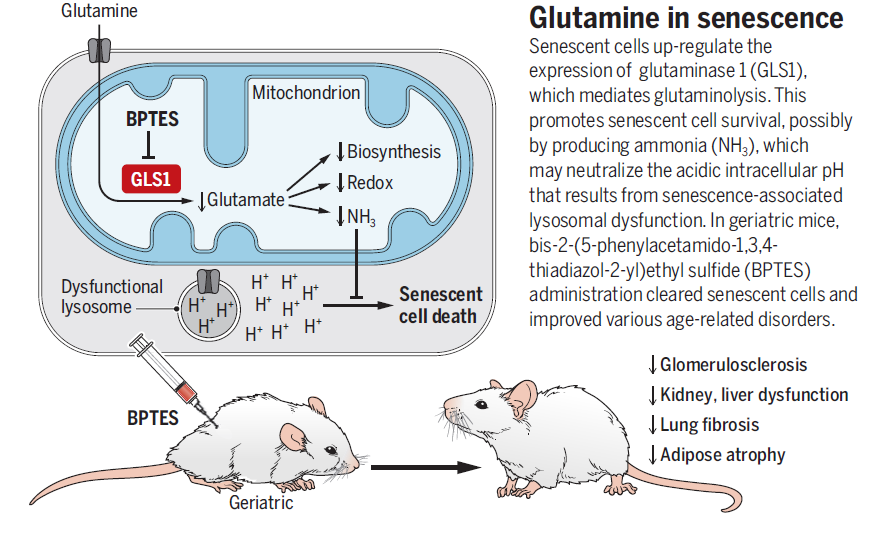
Science上刚发表的这项研究发现:衰老细胞中溶酶体损伤造成的H 溢出会诱发细胞内酸中毒,酸性环境会诱导肾型谷氨酰胺酶GLS1(KGA)的表达,促进谷氨酰胺分解产生氨去中和H ,维持衰老细胞的生存和细胞的衰老表型;靶向抑制GLS1可以促进衰老细胞的清除,改善和年龄相关的衰老病理情况。杂志同期发表了杜克大学医学院Christopher Pan和Jason W.Locasale的题为《Targeting metabolism to influence aging》的评论。评论指出,Makoto等人的工作提示了代谢调控在衰老过程中的重要性,揭示了谷氨酰胺代谢在维持细胞衰老过程中作用机制,为衰老细胞清除提供了特异靶点。同时,肿瘤治疗的临床研究已经确定了GLS1抑制的安全性,进一步增加了GLS1作为抗衰老靶标的吸引力。
衰老细胞中高表达的肾型GLS1(KGA)维持了衰老细胞生存
为了发现衰老细胞生存所需的蛋白和衰老清除的药物靶点,作者开发了一种长期培养高纯度诱导人类衰老细胞(n-Sen)的方法并做了shRNA文库筛选。
他们发现,谷氨酰胺酶GLS1在n-Sen细胞系中高表达,而且还是100多个代谢调控蛋白中上调最高的,同时,GDH、GS和EAAT3等上调谷氨酰胺分解的蛋白也在n-Sen细胞系中高表达。用基因敲除或者BPTES等小分子抑制GLS1后,n-Sen细胞死亡增加,该现象不依赖于营养条件。GLS1过表达不能使非衰老细胞系出现衰老表型。这些结果提示谷氨酰胺分解可以维持衰老细胞的生存,而GLS1的贡献尤为重要。
接下来,作者们探索了GLS1的分子调控机制。GLS1有两种同型异构体谷氨酰胺酶C(GAC)和肾型GLS1(KGA),KGA有长型和短型两种,KGA长型(KGA-L)转录本的3’-UTR有AU富集元件(ARE),酸性环境下,RNA结合蛋白HuC和ARE结合,提高KGA mRNA的稳定性。作者发现在衰老细胞系中诱导出的GLS1是KGA。双荧光素酶报告显示,和其他类型的转录本相比,KGA-L转录本在n-Sen细胞表达更高,但是在非诱导细胞系、HuC敲除的n-Sen细胞系、碱性培养的n-Sen细胞系中KGA-L转录本不稳定。这些结果提示衰老细胞中酸性环境稳定了HuC和KGA的mRNA结合,促进了KGA的表达。
谷氨酰胺分解反应有三个重要产物:α-KG、GSH和氨。为了探究哪一产物在该过程中发挥了作用,作者在n-Sen细胞中回补DM-α-KG、GSH-MEE和氨,发现氨可以阻断BPTES诱导的n-Sen死亡,碱性培养条件也有阻断效果。相关实验也证明,靶向抑制谷氨酰胺分解后衰老细胞死亡的原因可能是氨的生成被抑制导致细胞内酸中毒无法被中和。
溶酶体损伤导致细胞内酸中毒诱导了肾型GLS1(KGA)的表达
溶酶体中的不溶性大分子累积会造成溶酶体的膜损伤,引发溶酶体内H 溢出、细胞质pH值下降,导致细胞酸中毒。而溶酶体内容物增加和溶酶体活性改变是衰老细胞的重要特征之一。作者发现,在n-Sen细胞中,膜损伤标志物galectin-3和溶酶体标志物LMAP1发生了共定位,提示衰老细胞中的溶酶体发生了膜损伤。分别通过基因敲低TATA-盒结合蛋白1(TBP1)和核糖体蛋白L24(RPL24)抑制细胞内RNA和蛋白合成、减少大分子累积后,溶酶体损伤得到改善,细胞质pH值上升,细胞酸中毒得到缓解,减轻了BPTES诱导的n-Sen细胞死亡。
LLLOMe能够诱导溶酶体膜损伤。LLLOMe可以逆转TBP1和RPL24敲除带来的改善效果。TFEB-S211A可以促进溶酶体再生。在n-Sen细胞系中过表达TFEB-S211A后,溶酶体活性上升,galectin-3表达水平、蛋白聚集水平、溶酶体内pH水平降低,同时,KGA的表达和稳定性下调,细胞内酸中毒下调,细胞对BPTES诱导死亡的敏感性下调。即使在非衰老细胞中,LLOMe也能诱导KGA的表达,使细胞对BPTES诱导的死亡更加敏感。该结果进一步说明,溶酶体损伤是诱导KGA表达的上游事件,溶酶体损伤造成H 溢出和细胞内酸中毒,诱导了KGA表达。
人和小鼠的衰老组织中肾型GLS1(KGA)的高表达与组织和细胞的衰老表型紧密相关
在人皮肤成纤维细胞中,KGA转录本的表达水平和衰老程度呈正相关。用80周龄雄性小鼠作为衰老小鼠模型,和12周龄小鼠相比,衰老成纤维细胞表面标志物CD26在衰老小鼠的肺间质中表达上调,而BPTES处理后衰老小鼠的CD26表达降低。衰老小鼠的脂肪组织中超过30%的lamin B1阴性(核膜损伤)细胞是CD26阳性的。对公共数据库的单细胞数据进行分析发现,CD26在衰老细胞中的阳性率更高。流式分析发现,在衰老小鼠的脂肪、皮肤和肺间质细胞中,约1~10%的细胞是CD26阳性细胞,和CD26阴性细胞群相比,在CD26阳性细胞群中,衰老标志物SA-β-gal阳性细胞比例更高,galectin-3阳性细胞比例更高,KGA和p16的表达水平更高。这些结果提示,在体内,衰老细胞溶酶体损伤后会引发的细胞内酸化诱导KGA的表达。
GLS1抑制剂BPTES能缓解小鼠的衰老相关病理症状
那么抑制GLS1是否可以改善衰老小鼠的器官功能紊乱?用BPTES处理衰老小鼠模型后,BPTES改善了年龄衰老相关肾小球硬化、肾巨噬细胞浸润和肾功能障碍、肺纤维化、肝脏巨噬细胞浸润和血清白蛋白浓度。成脂祖细胞的衰老以及随后脂肪组织的萎缩和巨噬细胞浸润是自然衰老的特征。而BPTES可以消除衰老小鼠的SA-β-gal阳性细胞群,改善血清游离脂肪酸,缓解100周龄雄性衰老小鼠脂肪组织的萎缩和巨噬细胞浸润。BPTES还缓解了年龄相关的握力、短悬挂耐力以及细胞动力的衰弱。有报道称用衰老清除药物靶向衰老细胞能缓解肥胖引起的紊乱。对高脂饮食诱导肥胖的小鼠用BPTES处理1个月发现,脂肪组织的重量和大小下降了,SA-β-gal阳性细胞群和脂肪组织巨噬细胞浸润下调了。BPTES还能减弱胸主动脉粥样硬化小鼠的斑块和病灶数目。
总结
Makoto等人的工作揭示了衰老和代谢之间的联系:衰老细胞溶酶体损伤造成的H 溢出会诱发细胞内酸中毒,酸性环境会诱导肾型谷氨酰胺酶GLS1(KGA)的表达,促进谷氨酰胺分解代谢产生氨去中和H ,维持衰老细胞的生存和细胞的衰老表型,而靶向抑制GLS1可以促进衰老细胞的清除,改善和年龄相关的衰老病理情况。该研究提出GLS1是重要的衰老调控因子,为特异性靶向衰老细胞清除提供了理论基础和新靶标。
- 0000
- 0000
- 0000
- 0000
- 0000